Los compuestos estudiados pueden dividirse en :
1.-compuestos alifáticos
2.-compuestos aromáticos
3.-compuestos heterocíclicos
4.-compuestos organometálicos
1.-compuestos alifáticos
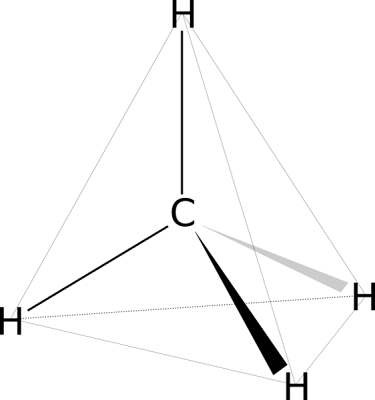
Los hidrocarburos alifáticos son compuestos orgánicos constituidos por carbono e hidrógeno, en los cuales los átomos de carbono forman cadenas abiertas. Los hidrocarburos alifáticos de cadena abierta se clasifican en alcanos, alcenos o alquenos y alcinos o alquinos.
Una cadena alifática alcana es una agrupación hidrocarbonada lineal con la fórmula:
CH3-(CH2)n-CH3
Si la cadena alifática se cierra formando un anillo, se denomina hidrocarburo alicíclico, hidrocarburo alifático cíclico o cicloalcano.
2.-compuestos aromáticos
Un hidrocarburo aromático es un polímero cíclico conjugado que cumple la Regla de Hückel, es decir, que tienen un total de 4n+2 electrones pi en el anillo. Para que se dé la aromaticidad, deben cumplirse ciertas premisas, por ejemplo que los dobles enlaces resonantes de la molécula estén conjugados y que se den al menos dos formas resonantes equivalentes. La estabilidad excepcional de estos compuestos y la explicación de la regla de Hückel han sido explicados cuánticamente, mediante el modelo de "partícula en un anillo".
Originalmente el término estaba restringido a un producto del alquitrán mineral, el benceno, y a sus derivados, pero en la actualidad incluye casi la mitad de todos los compuestos orgánicos; el resto son los llamados compuestos alifáticos.
El máximo exponente de la familia de los hidrocarburos aromáticos es el benceno (C6H6), pero existen otros ejemplos, como la familia de anulenos, hidrocarburos monocíclicos totalmente conjugados de fórmula general (CH)n.

3.-compuestos heterocíclicos
Los compuestos heterocíclicos son compuestos químicos orgánicos cíclicos en los que hay al menos un átomo distinto de carbono formando parte de la estructura cíclica. Los átomos distintos de carbono presentes en el ciclo se denominan heteroátomos.
Los ciclos pueden ser de diferente tamaño; los más comunes tienen entre 3 y 6 átomos, pudiendo ser mayores. También pueden contener uno o más heteroátomos diferentes, normalmente oxígeno, nitrógeno o azufre. Pueden ser además aromáticos, insaturados o saturados.
La química de heterociclos tiene una enorme importancia, tanto en la industria química farmacéutica como en la bioquímica y la química; por ejemplo, las bases nitrogenadas del ADN son heterociclos.
4.-compuestos organometálicos
Un compuesto organometálico es un compuesto en el que los átomos de carbono forman enlaces covalentes, es decir, comparten electrones, con un átomo metálico. Los compuestos basados en cadenas y anillos de átomos de carbono se llaman orgánicos, y éste es el fundamento del nombre organometálicos. La característica de estos compuestos es la presencia de enlaces entre átomos de metal y de carbono (que pueden ser sencillos, dobles o triples) y por tanto no se consideran organometálicos aquellos compuestos en que un metal se une a una molécula o fragmento por un átomo distinto del carbono, como ocurre en algunos compuestos de coordinación. Este grupo incluye un elevado número de compuestos y algunos químicos lo consideran un grupo distinto al de los compuestos orgánicos e inorgánicos.
Formalmente, los compuestos organometálicos son aquellos que poseen, de forma directa, enlaces entre átomos de metal (o metaloides) y átomos de carbono, M+δ–C-δ, de mayor o menor polaridad.[1] Es decir, un compuesto es considerado como organometálico si este contiene al menos un enlace carbono-metal. En este contexto el sufijo “metálico” es interpretado ampliamente para incluir tanto a algunos no metales (como el fósforo) y metaloides tales como B, Si y As así como a metales verdaderos. Esto es debido a que en muchos casos la química de los elementos B, Si, P y As se asemeja a la química de los metales homólogos respectivos. Por lo tanto, el término de compuestos organometálicos es también usado ocasionalmente para incluir dentro a los ya mencionados no metales y semimetales. En todos los casos se trata de elementos menos electronegativos que el carbono.

5.-polímeros
Los polímeros son macromoléculas (generalmente orgánicas) formadas por la unión de moléculas más pequeñas llamadas monómeros.